发布日期:2024-12-15 来源:中国科普博览
出品:科普中国
作者:王飞
监制:中国科普博览
编者按:为了解前沿科技动态,科普中国前沿科技项目推出“带你读懂科学顶刊”系列文章,精选权威期刊的优秀论文,第一时间用通俗语言进行解读。让我们透过顶刊之窗,拓宽科学视野,享受科学乐趣。
脊髓损伤作为日常生活中难以完全避免的严重外伤类型,其成因多样,包括但不限于交通事故、高空坠落及运动意外,这些均可导致脊髓受损并进而影响神经功能。
一旦脊髓这条连接大脑与身体的信息通道受损,受损部位以下的身体将丧失运动及感觉功能,会极大地降低患者的生活质量。脊髓损伤无疑是神经损伤中最为严峻的一类,若治疗不当,往往意味着永久的运动与感觉丧失,造成终身残疾。
在脊髓损伤发生后,周围细胞会迅速响应,形成保护性疤痕组织,以稳固并保护损伤区域。然而,随着自愈过程的推进,过量的疤痕组织却可能成为阻碍神经再生的障碍,最终导致永久性神经损伤。
因此,如何有效控制疤痕形成,成为脊髓损伤治疗领域的关键研究方向。
治疗脊髓损伤的新方式
在脊髓损伤治疗领域,可以通过“能溶解疤痕并让神经穿过屏障”的酶来提高治愈率,也有研究提出疤痕修剪在陈旧性脊髓损伤治疗中的重要性。但是,目前人们对于疤痕形成的分子机制尚不清楚,无法从根本上治愈脊髓损伤。
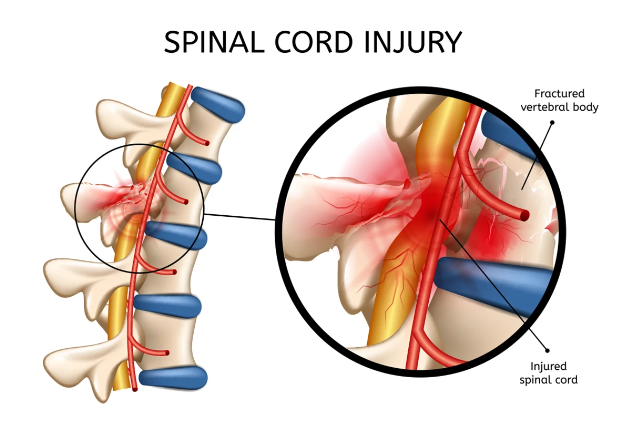
脊髓损伤和部分脊柱椎骨骨折
(图片来源:Aurora Health Care官网)
2024年9月18日,顶级学术期刊Nature杂志发表了一项重要研究,由余穎思(Wendy Yue)博士领导,她是2021年诺贝尔生理学和医学奖得主David Julius实验室的独立研究员。该研究揭示了脊髓损伤中影响疤痕形成的一条关键信号通路——Kappa阿片类信号通路,为未来开发相关药物提供了潜在靶点。
这项研究表明,该信号通路在正常情况下保持活跃,但在脊髓损伤后会被抑制。通过药物手段重新激活此通路,为调节脊髓损伤后的疤痕形成提供了新思路。

研究成果题目和作者
(图片来源:Nature杂志官网)
脊髓中的Kappa阿片类信号通路
脊髓内部存在一个名为中央管的结构,它沿脊髓纵向延伸,并被室管膜细胞所包围。这些室管膜细胞作为干细胞库,在脊髓受损时会大量增殖,并参与疤痕的形成。然而,关于室管膜细胞增殖的具体调控机制尚不完全清楚。先前的研究暗示,γ-氨基丁酸(GABA)这一抑制性神经递质可能在其中扮演一定角色,但具体机制仍需进一步探索。
室管膜细胞附近存在一类直接和脑脊液接触的神经元(CSF-contacting neurons, CSF-cN),刚巧表达γ-氨基丁酸。这些细胞在脊椎动物中高度保守,形态独特且功能重要。它们的胞体嵌入室管膜层内,从室管膜层延伸出一个薄薄的突起到中央管中,突起的末端形成球状的膨大,用来和脑脊液接触。
可是,之前关于这类细胞的研究很少,主要是因为缺少标记这类细胞的遗传学手段。不过,通过创新的脑室内注射腺相关病毒(AAV)技术,余博士成功标记了这些细胞,并揭示了它们不仅局限于中央管,还向脊髓腹侧白质发送投射。
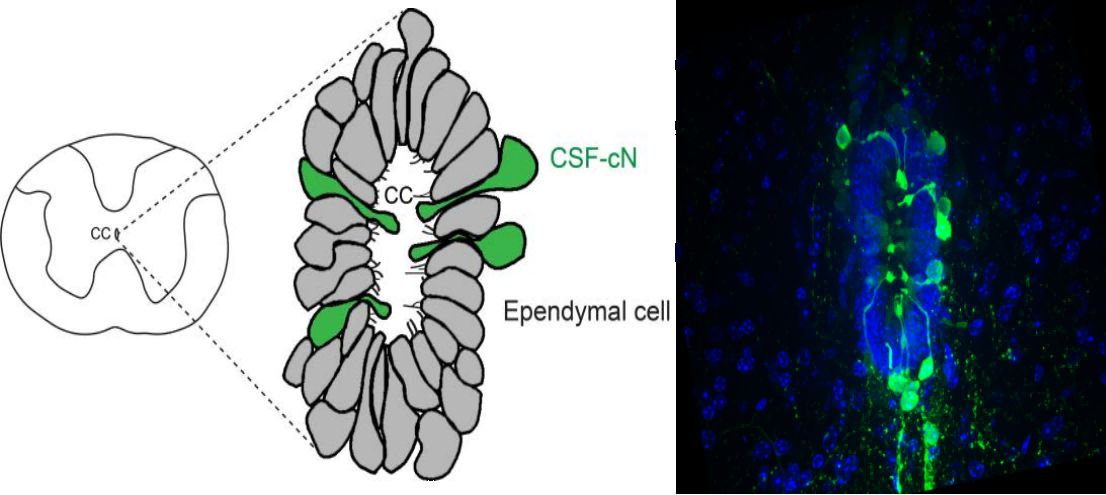
中央管和周围细胞
(图片来源:余穎思博士提供)
AAV感染的方法使研究团队能够分离出CSF-cN进行批量RNA测序,他们发现这些细胞表达Kappa阿片类药物的受体OPRK1。通过电生理和钙成像记录脊髓切片,他们功能性地验证了该受体的激活确实能够刺激CSF-cN的功能。
此外,余博士还发现CSF-cN邻近的细胞表达强啡肽前体(Pdyn),该前体在分解过程中会释放包括强啡肽A(DYNA)在内的活性肽。DYNA作为Kappa阿片类药物受体的内源性配体,能够激活CSF-cN。
通过一系列实验验证,余博士最终在脊髓中央室管膜附近找到了一条完整的Kappa阿片类信号通路。

CSF-cN邻近的细胞表达强啡肽前体
(图片来源:参考文献1)
Kappa阿片类信号通路在病理条件下被抑制
为了验证这一发现的临床意义,余博士利用胸腺嘧啶核苷类似物(EdU)标记增殖的细胞,并在体内实验中分别注射Kappa阿片类信号通路的激动剂(Nalfurafine)和拮抗剂(Nor-BNI)。他们想弄清楚,在激活这条通路和抑制这条通路时,脊髓里的干细胞到底是不是会增殖。
他们的假设是:这条Kappa阿片类信号通路在体内保持持续活跃的状态,从而抑制室管膜增殖。在脊髓损伤时,这条通路被抑制,干细胞开始增殖。大多数室管膜来源的干细胞分化为星形胶质细胞,它们会迁移到病变部位并形成胶质疤痕组织的中心。
他们的结果很好地验证了这一假说。结果显示,拮抗剂增加EdU标记的细胞的数量,说明抑制这条通路时,干细胞才会增殖。相反,在脊髓背侧半切的损伤模型中,本已被抑制的Kappa阿片类信号通路,注射激动剂让它再次激活,模拟回到正常生理情况下时,室管膜增殖的程度降低了。
在脊髓损伤模型的小鼠中,他们发现Kappa阿片类信号通路被激活时,小鼠脊髓损伤处形成的疤痕减少,脊髓损伤更严重,小鼠也更难恢复运动协调能力。
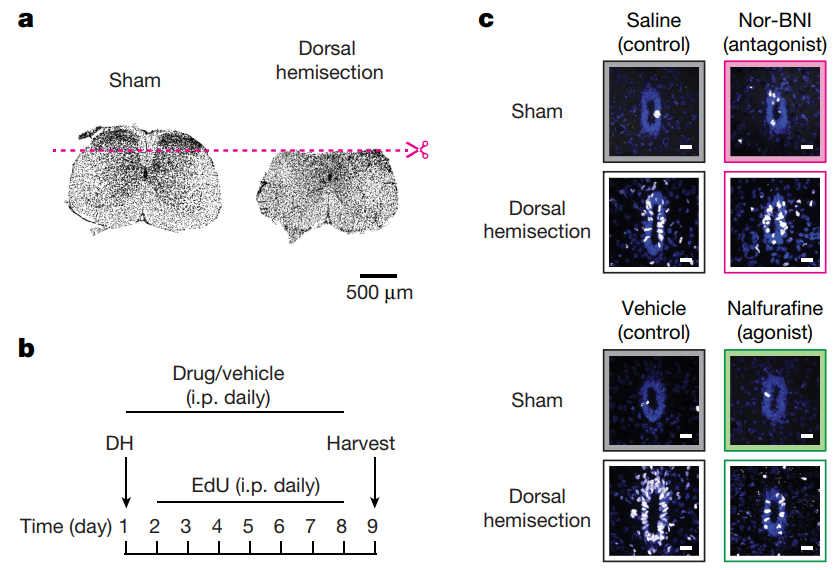
脊髓背侧半切的损伤模型
(图片来源:参考文献1)
胶质疤痕是一把双刃剑
胶质疤痕有助于防止脊髓进一步受伤,但也阻碍了神经纤维的再生。因此,如何在减少疤痕形成的同时又不损害脊髓的自然修复能力,是治疗脊髓损伤的关键。余博士基于之前的研究,提出是否系统性施用Kappa阿片类药物可作为控制胶质疤的一种手段。
“通过药理学手段调节Kappa阿片类药物的水平,以在脊髓损伤后产生适量而非过度的疤痕组织”这一策略不仅具有创新性,而且具有潜在的临床应用价值,因为Kappa阿片类药物相比传统商业阿片类药物具有较低的成瘾风险。
然而,要实现这一目标,还需要解决一系列关键问题,包括探究为什么Kappa阿片类药物水平在脊髓损伤后会下降、确定支持最佳愈合的疤痕水平是多少,以及进行必要的临床前研究以优化药物的应用时间和剂量。
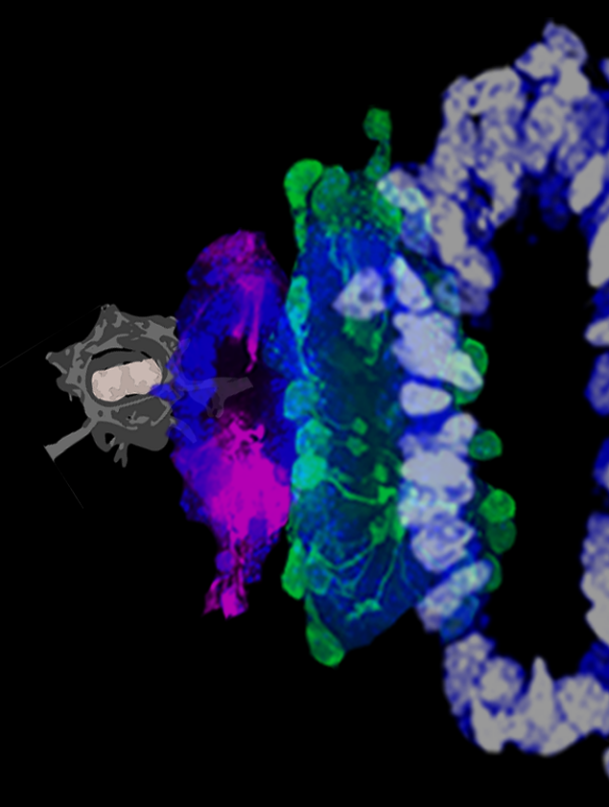
脊髓中央管附近的细胞
(图片来源:余穎思博士提供)
结语
这一研究结果使我们加深了对脊髓增殖的了解,在正常健康条件下,来自邻近的PDYN阳性细胞释放Kappa阿片类配体,CSF-cN因表达Kappa阿片类受体而被激活,兴奋的CSF-cN会释放GABA或其他减少室管膜细胞增殖的抑制信号。而在脊髓损伤情况下,由于PDYN阳性细胞遭受物理损伤,Kappa阿片类信号传导停止,导致CSF-cN对室管膜增殖的抑制作用减弱,室管膜细胞开始增殖,形成的星形胶质细胞聚集形成疤痕组织。
这一研究结果为哺乳动物脊髓损伤诱发的室管膜细胞增殖的调节步骤提供了新的见解。余博士说:“Kappa阿片类药物可能为我们提供一种方法,在脊髓损伤后,通过药理学调节不足疤痕组织和过度疤痕组织之间的平衡”。
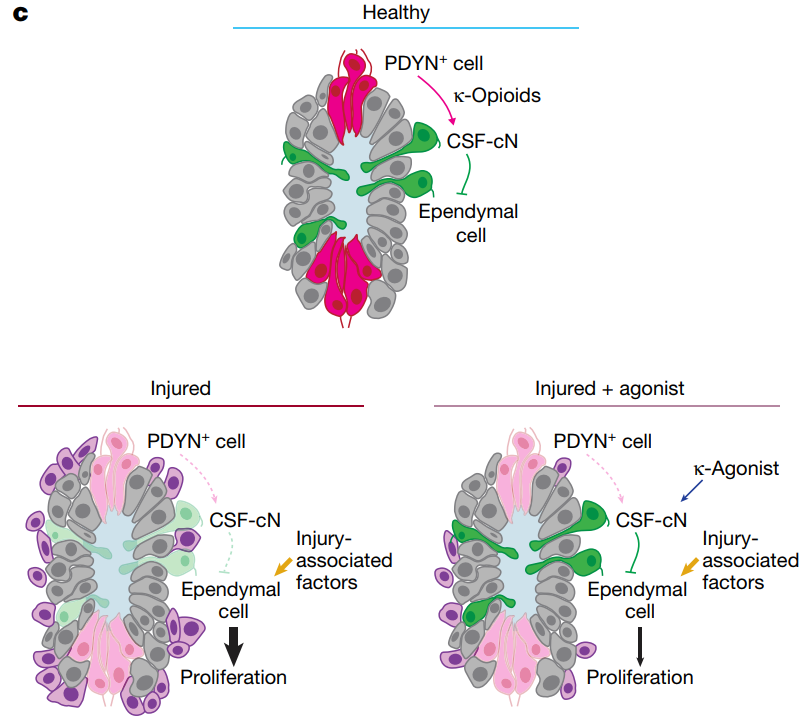
研究总结示意图
(图片来源:参考文献1)
参考文献:
1.Yue WWS, Touhara KK, Toma K, Duan X, Julius D; Endogenous opioid signaling regulates spinal ependymal cell proliferation.; Nature; 2024
2.Zhao, C., Rao, JS., Duan, H. et al. Chronic spinal cord injury repair by NT3-chitosan only occurs after clearance of the lesion scar. Sig Transduct Target Ther 7, 184 (2022).
3.脊髓损伤神经修复临床治疗指南(IANR/CANR 2019年版) 西部医学2020年6月第32卷第6期 Med J West China,June 2020,Vol.32,No.6

- 评论